硫化钠的主要应用_凯茵工业添加剂
背景及概述[1]
硫化钠又称“硫化碱”,是氢的钠盐,分子式Na2S。俗名“臭碱”。纯硫化碱为易潮解的白色粉末,也有片状和块状的。极易溶于水,微溶于酒精,不溶于,对大多数金属有轻微腐蚀性。与酸类发生反应,散发出有毒和易燃的硫化氢气体。吞咽或吸入其粉尘,对人体有害,对皮肤、眼睛和粘膜都有腐蚀性。相对密度:2.427(16℃/4℃),熔点:50℃;应存放于通风,干燥处,避光储放,容器要密封,防止受潮变质。远离热源与生活区,与爆炸物、酸类、氧化剂等隔离。装卸时要戴防护用具及胶皮手套。消防可用水或砂土。本品可用钠和碳素混合燃烧使钠被还原而制成硫化钠。主要用于制备硫化染料和用作有机化学工业中的还原剂。人体中毒时应迅速移到新鲜空气处,必要时需进行人工呼吸。皮肤受伤用水及稀醋酸洗涤。本品如含结晶水少于30%,则应属4.2类易燃物质。联合国编号(UNNo.):1849/8227/8-08/225,国内品名编号:82011,腐蚀品。
应用[2]
1. 硫化钠在冶金中的应用
1)稀土淋出液除杂在处理风化壳淋积型稀土矿时,当用某强电解质溶液淋洗浸取后,得到的稀土淋出液常含有大量杂质离子,如Al3+、Fe3+、Ca2+、Mg2+、Cu2+等。利用草酸沉淀工艺时,这些杂质难免会形成草酸盐沉淀转入稀土产品,影响产品纯度。而且,为避免在后续萃取工艺中产生乳化现象,必须先将料液中杂质离子除去。几种金属硫化物沉淀的溶度积常数如附表所示,当向稀土淋出液中加入Na2S后,可将溶液中重金属离子Cu2+、Pb2+、Zn2+等有效除去。研究表明,控制pH在5左右,向稀土淋出液中加入Na2S除杂,不但除杂效果好,并且不损失稀土。
2)处理含汞废水含汞废水对环境以及人类健康都有极大危害,在制碱工业中,排放废水中汞的含量一般都较高,超过国际(0.05mg/L)。在弱减性(pH8~11)溶液中,汞离子能与硫化钠生成难溶于水的沉淀,从附表可以看出,HgS的溶度积很小(Ksp=1.6×10-52)。通过研究确定了在Na2S用量一定,控制pH值9~10时处理效果好,可将废水中Hg2+降至国标(0.05mg/L)以下。另外,通过加入FeSO4在水中生成Fe(OH)2和Fe(OH)3胶体,这些胶体不但能吸附汞离子,且能捕集和裹覆悬浮的HgS固体微粒,起到良好的混凝沉淀作用。沉渣不易二次污染,便于处置。
3)利用Na2S除砷砷一般以硫化物形态存在于矿物中。在火法冶炼过程中,大部分砷挥发进入烟气和烟尘,特别是低浓度SO2直接排放会污染环境。因此,在烟气后续处理或排空之前,应先进行脱砷处理。采用Na2S溶液吸收SO2烟气,使As3+与S2-生成As2S3沉淀(Ksp=2.1×10-22),在较高pH下(pH>8),As2S3可溶解生成As3S3-6或AsS2-3,较低pH下,溶液会产生H2S气体。尹爱君等[4]的研究表明:当控制溶液pH在2.0~5.5范围,反应时间50min,反应温度30~50℃,以及加入絮凝剂的条件下,可较好除砷,除砷率可达90%以上。在药用白炭黑的生产中,为降低生产原料浓中杂质砷的含量,向浓中加入硫化钠,使As3+生成As2S3沉淀除去。生产实践表明:硫化钠除砷不仅反应速度快,而且除砷彻底。除砷后的中砷含量达0.5×10-6以下,用此原料生产的白炭黑含砷量≤0.0003%,完全符合美国药典的规定。
4)Na2S在电镀中的应用
Na2S在电镀中作为光亮剂:硫化钠溶于水后电离成带正电荷的钠离子(Na+)和带负电荷的硫离子(S2-),在电镀过程中,电解液中S2-的存在可促使阴极极化,在同样电流下,使阴极反应速度加快。沉积速度也随之加快,深镀能力增加,镀层细化,镀件表面相应变得更加光亮。
硫化钠在电解液中除杂:在电镀生产过程中,原料中的杂质或多或少会被带入到镀液中。这些杂质在电极作用下,发生不同反应,电位较低的杂质会与Zn2+一起沉积在镀件表面,影响镀层质量。加入硫化钠后,硫化钠中S2-能与金属杂质离子生成沉淀物,避免杂质参与电化学反应,使镀层光亮。
5)利用Na2S溶液进行烟气脱硫目前,烟气中SO2的回收方法主要是将SO2转变为H2SO4、液态SO2及单质硫。由于单质硫便于装卸和运输,因此它也是一种理想的回收产品。利用Na2S溶液制取的H2S为还原剂还原SO2制得单质硫的新工艺。此工艺简单,无须象一般生产技术一样需消耗如天然气及低硫煤等昂贵的还原剂。当溶液pH降至8.5~7.5时,用Na2S吸收SO2就会产生H2S,在液相中H2S与SO2发生湿式Claus反应:
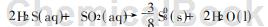
2. 硫化钠在选矿中的应用
1)硫化钠作为抑制剂硫化钠对硫化矿的抑制作用一般认为主要是两方面,一是Na2S水解产生HS-,HS-排除硫化矿物表面吸附的黄药,同时本身又吸附在矿物表面增加矿物表面的亲水性;另一方面,认为Na2S起抑制作用不仅仅是HS-吸附在矿物表面引起的,还应与Na2S在水溶液中电离生成的S2-有关。例如:方铅矿中加入Na2S和黄药时,存在下列平衡

由于PbS的溶度积大,而PbX2的溶度积小,当加入Na2S时,S2-浓度增加,平衡向左移动,使得附着在矿物表面的黄药脱附,从而使Na2S在矿物表面产生抑制作用。利用Na2S的抑制作用,通过加入Na2S抑制Ni2S3的浮选,从而可实现高冰镍中Cu2S与Ni2S3的有效分离。在某些铅锌选矿厂,因设备问题和生产工艺不合理,使浮选后渣中仍含有较高铅锌。但由于其表面吸附了一定浮选药剂,长期堆放产生严重泥化,给铅锌中矿的再分选造成极大难度。利用Na2S的抑制作用,可将Na2S用作脱药剂,将已吸附于矿物表面的黄药解吸下来,使后续浮选作业易于进行。对陕西鑫河选矿厂堆存的铅锌中矿利用硫化钠进行脱药预处理,然后再进行浮选的工艺得到含铅63.23%的铅精矿和含锌55.89%的锌精矿(铅和锌的回收率分别可达60.56%和85.55%),充分利用了二次矿产资源。在铜锌类硫化矿的分选中,由于矿物致密共生,含硫和次生铜高等特点,使分选难度大,这种矿石在磨矿过程中闪锌矿已被Cu2+活化,其可浮性与黄铜矿接近,因而使铜、锌矿物不易分开。在处理此种矿石时,通过在磨矿时加入Na2S,使Na2S水解产生的S2-与某些具有活化能力的重金属离子,如Cu2+生成难溶硫化物沉淀,清除这些重金属离子的活化作用。再通过加入锌和硫的抑制剂,利用丁铵黑药优先选铜—选铜尾矿选锌—选锌尾矿选硫工艺得到含铜25.10%的铜精矿、含锌41.20%的锌精矿和含硫38.96%的硫精矿。
2)硫化钠作为活化剂:对菱锌矿—褐铁矿体系的浮选研究表明,在褐铁矿胺浮选中,只有在较低pH下,胺才可以通过静电力吸附在矿物表面。但在加入Na2S后,使褐铁矿表面形成FeS膜,由于较高pH下,FeS膜可增加对分子态胺的吸附,因此以FeS试剂颗粒做浮选,可在高pH下对褐铁矿进行胺浮选。另外,Na2S可作为氧化铜矿物的浮选活化剂。当适量的Na2S加入浮选溶液中后,离解出的S2-与氧化矿物表面晶格阴离子发生置换反应,使氧化铜矿物表面生成硫化物薄膜,从而有利于黄药类捕收剂的吸附。但氧化铜矿表面生成的硫化铜薄膜不十分牢固,搅拌强烈时易脱落下来。在处理湖北大冶石头嘴铜矿(以孔雀石为主的含铜矿物)时,利用多段添加Na2S,多点出精矿的浮选方法,减少了中矿的循环,铜精矿品位比生产工艺提高了2.1%,铜、金回收率分别提高25.98%和10.81%。Na2S还可用于高碱石灰体系中被高碱石灰抑制的黄铁矿的浮选活化剂。高碱体系中,黄铁矿表面覆盖了亲水性钙膜(Ca(OH)2、CaSO4),使其浮选受到抑制。研究表明,加入Na2S后,水解出的HS-离子一方面可排挤覆盖在黄铁矿表面的Ca(OH)2、CaSO4及Fe(OH)3等,同时其本身又可吸附于黄铁矿表面。由于黄铁矿具有传递电子的能力,当黄铁矿的界面电位大于EHS/S0时,HS-在黄药表面失去电子,生成疏水性的元素硫。生成的元素硫包裹在矿物表面,从而使其活化,易于浮选。
3)硫化钠作为金银矿物的诱导浮选剂:由于金矿石的无捕收剂浮选充分利用了电化学原理及硫化物和金银矿物表面的电子差异,因此,无捕收剂浮选具有更高的选择性,更简单的药剂制度。另外,它消除了黄药类捕收剂浮选中难以控制的无选择性吸附,解决了氰化物浸金之前的脱药问题和捕收剂膜阻隔浸金的问题,因此,近几年关于金银矿物无补收剂浮选的研究比较多。金银矿石中的金与硫化矿物常共生,特别是金与黄铁矿有紧密依赖关系。由于黄铁矿表面具有半导体性质和一定的电子传输能力,而且,通过黄铁矿的表面静电位与HS-/S0电对EHS-/S0比较,在矿浆pH处于8~13范围内,黄铁矿表面静电位始终高于EHS-/S0。因此,Na2S在矿浆中电离出的HS-、S2-均会在黄铁矿表面放电生成元素硫。电极反应如下:

制备[3]
一种高纯硫化钠制备工艺,包括以下步骤:
(1)、按1:3-4的比例称取原煤和钠,将称取的原煤和钠置于球磨机内进行磨粉;
(2)、将步骤(1)制得的粉料物置于煅烧炉内进行煅烧处理,控制煅烧温度为1000℃-1100℃,控制煅烧时间为30-50min,既得硫化钠半成品;
(3)、将步骤(2)制得的硫化钠半成品加水稀释成硫化钠溶液,进行2-3次过滤澄清处理;
(4)、将步骤(3)处理后的硫化钠溶液打至除铁器中,加入0.1-0.3%wt的多聚铁使生成的各种沉淀物质沉降,搅拌20-30min,温度70-80℃过滤,得铁含量在10ppm以下的硫化钠溶液;
(5)、将步骤(4)的溶液蒸发浓缩至60%含量,制片即得铁含量在10ppm以下的硫化钠产品;
(6)、在锌溶液中加入金属锰粉和/或锰基合金粉,温度为50-60℃、且pH>4.5,搅拌反应,反应完成后,过滤分离,之后经蒸发浓缩结晶,得到高纯度锌,将制备的高纯度锌按每立方滤液加入锌5-8千克量称取锌,每立方滤液对应配制1立方锌溶液;按每立方水中加入硫化钡140kg,取清液备用;将以上两种配好的溶液,同时加入硫化钠滤液中,搅拌,反应温度控制在80-90℃以上,沉淀,除杂澄清后,送蒸发工序,经蒸发浓缩即得到高纯度硫化钠。
主要参考资料
[1] 集装箱运输业务技术辞典·下册
[2] 硫化钠在冶金、选矿中的应用
[3] CN201810763300.3一种高纯硫化钠制备工艺


