1,3,5-三氟的应用_凯茵工业添加剂
背景及概述[1][2]
在化学制药领域,由于氟原子的引入,含氟有机化合物大多具有其他有机化合物 不能比拟的特定,含氟有机化合物独特而优良的性能引起人们对它的极大兴趣。近年来,含氟中间体由于具有出色的药理和生理活性而被越来越多的学者所研究。1,3,5-三氟可作为医药或液晶材料中间体。
应用[1-5]
1,3,5-三氟可作为医药或液晶材料中间体。其应用举例如下:
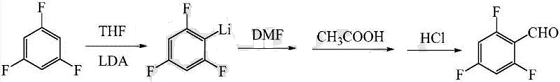
1. 制备2,4,6-三氟甲醛。
氟代甲醛是一类重要的有机化工原料及中间体,可广泛用于农药、医药、染料及树脂的合成。但因合成技术相对落后,导致供需缺口较大。因此,开发其制备新技术具有良好的经济效益和社会效益。目前,报道氟代甲醛的主要合成方法有卤化水解法、直接化学氧化法、电化学氧化法、氧气氧化法、卤交换法、氟甲酰法等。
制备方法包括:(1)制备二异丙基胺基锂的四氢呋喃溶液,待用;(2)降温至-85~-80℃,在氮气保护下,将二异丙基胺基锂的四氢呋喃溶液滴加到1,3,5-三氟的四氢呋喃溶液中,滴加完毕后保温反应3~5h;(3)向反应溶液中滴加二甲基甲酰胺,在-80~-75℃下保温50~70min;(4)保持温度在-5~0℃,向反应溶液中依次滴加冰醋酸、水和稀盐酸,调节pH至1~2,滴加完毕后搅拌10~20min得粗产物;(5)粗产物经后处理得到目标产物2,4,6-三氟甲醛。本发明运用非亲核性的有机碱二异丙基胺基锂,为制备2,4,6-三氟甲醛提供了新思路。
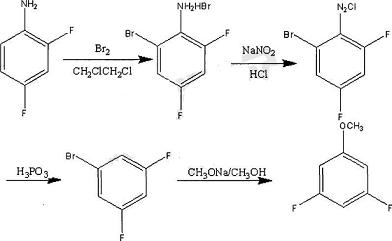
2. 制备2,4,6-三氟苄胺化合物。
2,4,6-三氟苄胺是一种重要的医药、农药中间体,其中一个用途是合成抗艾滋病药物Bictegravir。目前关于该化合物合成的报道较少,主要合成路线有:以1,3,5-三氟为原料,经过正丁基锂醛基化、还原、氯化亚砜氯代、乌洛托品烷基化成盐和水解等一系列反应得到2,4,6-三氟苄胺,此工艺路线繁琐,操作难度较大,不利于工业化生产。
以五氯腈为原料,与无水氟化钾反应得到3,5-二氯-2,4,6-三氟腈;3,5-二氯-2,4,6-三氟腈中加入有机碱、催化剂,通入氢气,经脱氯氢解得到2,4,6-三氟腈;2,4,6-三氟腈中加 入酸、第二催化剂,通入氢气,经氰基还原得到2,4,6-三氟苄胺,其中脱氯氢解和氰基还原 两步总收率低于60%,文献还给出3,5-二氯-2,4,6-三氟腈一步催化氢化还原得到2,4,6- 三氟苄胺,但收率低于30%。
有研究开发了一种新路线,以1,3,5-三氟为原料,经锂化、醛基化、还原、卤代和置换反应制备2,4,6-三氟苄胺方法,反应条件温和,可操作性强,原子经济性高,工艺简单易于实现工业化,并且产品纯度高,质量稳定,符合作为中间体的使用要求。
3. 制备3,5-二氟甲醚。
3,5二氟甲醚是一种重要的精细有机合成中间体,主要用于农药、医药及液晶材料的合成。 通过将1,3,5-三氟与甲醇钠溶液在溶剂存在的条件下进行反应,得到反应产物,再将所述的反应产物进行后处理,得到3,5-二氟甲醚,所制备的产品3,5-二氟甲醚纯度高,产品收率高,而且反应步骤少,产品生产周期短。
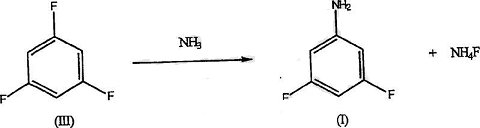
4. 制备3,5-二氟胺。
化合物3,5-二氟胺是合成许多阔叶除草剂以及其他农用化学器和药 物产品中的关键中间体。许多合成该化合物的途径已被研究过。然而,许多这类合成是困难的,或者不能提供足够的收率,或者是简单但昂贵的。例如,相对于氨基或硝基官能度而言,难以将两个氟取代基导入3和5位。 为此,已尝试了技术上复杂且昂贵的合成方案。
然而,不利的收产率和大 量的干扰反应副产物使这类合成并不实际可行。在农用化学品领域,成本研究反复表明仅短的合成路径(3步或更少)是经济可行的。有研究3,5-二氟胺可以通过如下方法以高收率和高纯度合成:在极性溶剂存在下氟化1,3,5-三氯以制备 中间体1,3,5-三氟,然后在氨水或无水氨存在下胺化1,3,5-三氟以得到所需的3,5-二氟胺。具体如下:使用装有标准搅拌器、温度计套管和阀门的600ml Hastelloy加压反应 器(Parr Instrument Co.,Moline,IL)。
向反应器中加入0.833摩尔1,3,5-三氟(110g)、4.6摩尔29%氨水(270g)和0.44摩尔氧化镁(17.8g)。 反应器用氩气冲洗并中热到225℃,直到达到大压力(约1400psig)。 随着反应的进行,压力以约20lbs./小时的速率降低约6小时。然后冷却反应器并使内容物沉降。从反应器底部排出油,直到观察到盐/水。盐漂浮在油上并在氨水中缓慢沉降。含水盐用MTBE萃取2或3次。
将该MTBE 与油合并并加入装有不锈钢填料(ProPak)的蒸馏塔中。离心分离盐,用水洗涤并丢弃。通过在大气压力下蒸馏MTBE、然后在20-50mm下蒸馏 DFA而分离产物。1,3,5-三氟在DEG中首先使一定量的1,3,5-三氟(TFB)与无水NH3在二甘醇(DEG) 中于200℃下反应。该反应不可接受地慢且向产物的转化率在3小时内约 为17%。该反应随后在230℃下进行。大压力为960psig。10小时后, TFB向3,5-二氟胺(DFA)的转化率为95%。气相色谱分析的总计量 (accountability)为97%。
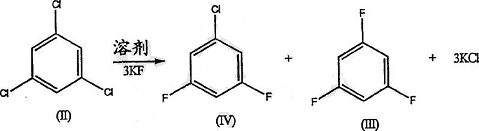
制备 [5]
将原料化合物1,3,5-三氯(II) 在溶剂中用氟化钾处理。产生少量包括3,5-二氟氯(IV)的副产物和大量氯化钾,同时还有所需的中间体化合物1,3,5-三氟(III)。
具体步骤如下:将2加仑(7.8升)搅拌的不锈钢加压反应器装上1″×10″装填有ProPak挤出金属填料的不锈钢蒸馏塔。塔顶装上回流冷凝器和用于排出气体和取出产物的针阀。在塔填料正上方装上热电偶。将该塔包上加热带并绝缘,以使热损失达到小。向该反应器中加入33.4摩尔无水N,N′-二甲基咪唑烷酮(DMI)(3800g)、6.15 摩尔1,3,5-三氟(TCB)(1118g)和22.2摩尔氟化钾(KF)(1286g)。然后密封反应器。充入氮气两次(200psig),然后排空以除去空气。
然后剧烈搅拌反应器(760r.p.m.)并加热至约310℃-约315℃。达到310℃后,通过冷凝器顶部的阀门从反应器中排空氮气。在加热约2-约2.5小时后,通过冷凝器顶部的输出阀以约100ml/hr的速率缓慢蒸除所生产的TFB。在约6-约7小时内除去TFB。然后冷却反应器并从DMI中滤除盐。用二氯甲烷洗涤盐以回收所有DMI。另外也可使用其他溶剂如甲基叔丁基醚 (MTBE)。合并滤液和溶剂洗涤液并蒸馏以回收洗涤溶剂和DMI二者。在大气压力下蒸馏MTBE,同时通过约118℃28mmHg的减压蒸馏回收 DMI。为了达到高纯度,必须再蒸馏TFB。
主要参考资料
[1] CN201610788956.1一种2,4,6-三氟甲醛的制备方法
[2] CN201410853129.7一种2,4,6-三氟苄胺化合物的制备方法
[3] CN200810084162.23,5-二氟甲醚的制备方法
[4] CN201810561854.5一种2,4,6-三氟苄胺的合成方法
[5] CN01804645.2 由1,3,5-三氯制备3,5-二氟胺的方法


