香草酸的应用_凯茵工业添加剂
背景[1][2]
香草酸系统名“4-羟基-3-甲氧基甲酸”。分子式C8H8O4。分子量168.14。白色针状晶体。无气味,能升华,不分解。熔点210℃。易溶于乙醇,可溶于,微溶于水。与三氯化铁作用不显色。香草酸是胡黄连有效成分之一。胡黄连苷类的结构中分别含有香草酸基、阿魏酸基和桂皮酰基,水解后即为香草酸、阿魏酸和肉桂酸,香草酸是胡黄连的抗菌成分之一,测定其所含的香草酸量,可以作为衡量胡黄连质量的指标。
目前市场上的香草酸主要来源于植物提取,生物发酵合成,化学合成等。植物提取法,原材料成本较高,且需要培育大量植物,受天气地域等影响较大,根本无法满足市场的需求。生物合成香草酸的工艺,受到底物、菌株和酶的限制,转化率不高,生产工艺并未能够得到广泛应用。香草酸的化学合成工艺,主要以香草醛为原料,通过氧化(氧化银)或碱熔(氢氧化钾,240℃以下)制备,也有从3,4-二甲氧基甲酸部分脱去甲基而得的工艺。
其中氧化法制备面临的成本高,污染大等缺点,不适合大规模生产。而碱熔工艺存在反应剧烈,安全性差,产能低等问题,工业应用也不广泛。而3,4-二甲氧基甲酸作为原料,相比香草醛价格昂贵,也不适合大规模生产。综上所述,现在香草酸合成工艺安全性差,产能低,收率低,操作复杂,收率及纯度 也较差。
结构
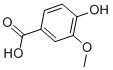
应用[2][3][4][5]
香草酸主要可用于香料或医药合成,如5-硝基香兰酸,它可用于3,5-双取代儿茶酚类儿茶酚-O-甲基转移酶(COMT-I)抑制剂托卡朋(tolcapone)的合成,或作为合成利福霉素类抗生素(3-羟基甲氧基利福霉素,3-羟基利福霉素)生物合成的前体。
香草酸作为香荚兰豆,香子兰荚,胡黄连等植物的有效成分之一,国内外对其抗菌消炎,抗氧化,抑制酪氨酸酶活性,化感作用,调节神经,促凝血活性方面都有一定的研究,具有较好的活性,具有很好的市场前景。其应用举例如下:
用于香草醛的合成。香草醛,又名香兰素(Vanillin),化学名为3-甲氧基-4-羟基甲醛(3-methoxy-4-hy dro xybenzaldehyde)。是一种广谱型高档香料,被誉为香料之王,广泛应用于食品、饮料、香料、医药等领域。年用量很大,产品多数为化学合成,纯天然产品主要是从香子兰花荚中提取,产量极少,远远不能满足市场的需求。
利用微生物转化天然前体生产的天然等同 (natur-identical ,NI)的香草醛,被称为“生物香兰素”,则可以替代天然香兰素。具体方法是,筛选到1 株可以转化香草酸生成香草醛的朱红密孔菌SW-0203,通过培养基和转化条件的优化后,可以将1.682 g/ L 的香草酸转化成0.875 g/ L香草醛,摩尔转化率为57.5%。在25 L 罐上进行放大试验,香草醛产量为0.818 g/ L,摩尔转化率为53.7%。对转化液中的产物进行提取,得到纯度为95 %的香草醛结晶,提取收率为63.9%。
此外,有研究采用酶动力学方法研究了香草酸对酪氨酸酶单酚酶和二酚酶活力的抑制效应,结果表明,香草酸对酪氨酸酶单酚酶和二酚酶活性均有抑制作用,导致单酚酶活力和二酚酶活力下降50%的香草酸浓度(IC50 )约分别为1. 3 mmo l /L和2. 6 mm ol /L。
香草酸能明显延长单酚酶的迟滞时间,2 mm o l /L香草酸能使迟滞时间由1.1 m in延长至4.7 m in。香草酸对二酚酶的抑制作用表现为混合型抑制,对游离酶的抑制常数(KI)和对酶-底物络合物的抑制常数(KIS )分别为1. 76 mm o l /L和8. 57 mmo l /L。
另外,还有研究探讨酚酸类自毒物质香草酸的自毒作用,研究其对花生种子萌发和幼苗生长的影响,揭示根际土壤微生物在花生生育期内对自毒物质的响应规律。以花生品种阜花12 号150GY 为试材,培养皿培养试验设6 个处理:0、0.01、0.03、0.05、0.07、0.09 mmol·L-1 香草酸溶液;营养钵种植试验设5 个处理:0、0.01、0.03、0.05、0.07 mmol·L-1 香草酸溶液;盆栽试验设5 个处理:香草酸用量分别为0、0.01、0.03、0.05、0.07mg·kg-1干土。
分别研究外源添加香草酸对花生种子萌发、幼苗生长及根际微生物区系的影响。结果显示:
(1)经不同浓度香草酸溶液处理后,花生种子的发芽率、发芽势和发芽指数均低于CK,与对照存在显著性差异。当香草酸溶液浓度为0.09 mmol·L-1 时,发芽率、发芽势和发芽指数与对CK 相比分别降低39%、66.3%和55.9%,自毒效应响应指数达到大值。
(2)经不同浓度香草酸溶液处理后,花生幼苗的主根长、单株干重、叶绿素含量、净光合速率和气孔导度均低于CK,与对照存在显著性差异,当香草酸溶液浓度为0.07 mmol·L-1 时,各指标与对CK 相比分别降低37.3%、40.0%、19.0%、53.9%和49.1%,自毒效应响应指数达到大值。胞间CO2 浓度变化趋势与以上指标相反,随香草酸浓度的增大而呈现上升趋势,当香草酸溶液浓度为0.07 mmol·L-1 时,胞间CO2 浓度比对照提高46.1%。
(3)香草酸浓度≥0.03 mmol·L-1 时,花生根系总吸收面积、活跃吸收面积和根系活力(活跃吸收面积/总吸收面积)低于CK,叶片的MDA 含量高于对照,均与对照存在显著性差异,当香草酸溶液浓度为0.07 mmol·L-1 时,各指标与对照相比分别降低22.4%,54.2%和40.6%,MDA 含量提高43.3%。
(4)根际放线菌数量在花生生育前期随着草酸浓度的增大而显著降低,进入结荚期后各处理间差异不显著。根际细菌数量在花生生育前期时各处理间差异不显著,而进入结荚期后随着香草酸浓度的增大而显著降低。高浓度的香草酸(0.07 mg·kg-1干土)对根际真菌生长具有抑制作用,而低浓度的香草酸(0.01 mg·kg-1 干土)对根际真菌生长具有促进作用。
因此,香草酸对花生种子萌发和幼苗生长存在一定的抑制作用,香草酸亦会抑制花生幼苗的光合作用,降低根系活力,促进幼苗叶片产生丙二醛。此外,不同浓度的香草酸溶液均会使花生根际细菌和放线菌的数量降低,抑制根际土壤中细菌和放线菌的生长繁殖,而对土壤真菌的影响呈现低促高抑的现象,即低浓度的香草酸溶液促进花生根际土壤中真菌的生长;而高浓度则对真菌生长具有一定的抑制作用。
制备[6]
将170g硝酸银溶于1L水配成的溶液 加到2L烧杯内,搅拌下用44g97%氢氧化钠溶于400ml 水所配制的溶液处理。将混合物搅拌5min,滤去氧化银,并用水洗涤以除去硝酸盐。将此氧化银移至4L烧杯中,加2L水,在剧烈搅拌下,用200g氢氧化钠固体处理。将混合物热至55~60℃。继续搅拌,加入152g香草醛。氧化银转变为金属银,并放出大量热。继续搅拌10分钟,过滤。用100ml热水洗涤沉淀的银。合并滤液和洗液,快 速通入二氧化硫2min。在剧烈搅拌下将生成的溶液倒入 1.1L的盐酸(1:1)中,冷至15~20℃,过滤,冰水洗涤。抽干,产量140~160g,产率83~95%。
主要参考资料
[1] 合成香料产品技术手册
[2] CN201820021553.9 一种香草酸连续化生产设备
[3] 王明君, 郑璞, 孙志浩, 等. 微生物转化香草酸生产香草醛[J]. 食品与发酵工业, 2004, 30(2): 43.
[4] 龚盛昭, 杨卓如, 林希. 香草酸对酪氨酸酶催化活性的抑制作用[J]. 精细化工, 2005, 22(12): 927-930.
[5] 黄玉茜, 杨劲峰, 梁春浩, 等. 香草酸对花生种子萌发, 幼苗生长及根际微生物区系的影响[J]. 中国农业科学, 2018, 51(9): 1735-1745.
[6] 段长强等,现代化学试剂手册(一),化学工业出 版社,507—508(1988)


